Abstract:
The age related deterioration of the fracture properties of bone is responsible for increasing incidence of bone fracture in the elderly. Bone fragility is influenced by bone size, shape, architecture and tissue quality. In this study tensile and compressive load tests are performed on both the genders on femur cortical bone with wide range of age group ranging from 19-83 years. The samples are collected from cadavers. An Instron 3366 table top model is used to perform mechanical tests. The results of the study show that stress induced in the bone tissue depends on age and gender. Young’s modulus is one of the factor for understanding elastic property of the bone, results show that it is directly associated with age and gender. The mean Young’s modulus in male is 338.3±179.74 MPa; in female it is found to be 404.7±314 MPa. An age related decrease in the strength suggests that fracture incidence is caused by the alteration in mode and magnitude of microdamage formation.
Keywords:
Age; femur bone; Young’s modulus; tensile strength; compressive strength.
J.Orthopaedics 2012;9(3)e4
Introduction :
Bone is a complex, highly organised and specialised connective tissue. It is characterised physically by the fact that it is a tissue that is hard, rigid and strong. According to Vashishth et al. [1],the skeletal strength and shape can be influenced by a variety of factors such as mechanical loading, genetics, pharmacological agents and nutritional intake. Bone tissues are specialised connective tissues made up of cells including osteoblasts, osteocytes, bone-lining cells and osteoclasts which produces, maintains and organises the cellular matrix. Skeletal fragility among the elderly is the most significant health problem associated with bone. After middle age, the risk of fractures increases with age and fractures can occur in the absence of a traumatic overload. Non-traumatic fractures are usually associated with osteoporosis. For instance, fracture risk increases with age even when risk is adjusted for bone mass, indicating that bone tissue competence is compromised with age. Bone mineralisation and carbonate substitution increases with age where this does not decide bone strength. This may contribute to age-related skeletal fragility. The most important parameter deciding tissue quality in terms of its elastic properties is collagen organisation and its structure in the bone [2].
Studies on the distribution of stresses and strains within the organic and mineral components may highlight the nano structural origin of damage in bone. When bone is subjected to axial tensile stresses, the organic matrix is subjected to both normal and shear stress that may cause nanoscale damage in the organic matrix of bone. Organic matrix is made up of type I collagen, acts as a composite material itself. The collagen fibrils transfer the tensile forces from one fibril to the next through shear stresses that are generated along the overlap region of the fibrils [3, 4]. Deformation of collagen fibres involves molecular stretching and slippage, fibrillar slippage and ultimately defibrillation. These mechanisms decrease the fibril diameter and increase the toe region during subsequent tensile testing.
Compression fracture in cortical bone depends strongly on the bone tissue volume fraction, the architecture and the mechanical properties of the bone tissue. As pointed out by Vikas Tomar [5] the cortical bone failures is sensitive to intra and inter specimen variations in architectural features as well as in material properties. Studies of the nano scale damage mechanism in connective tissues made of type I collagen have been conducted by mechanically loading these tissues and introducing damage in their ultrastructure [6].
In our study Young’s modulus was calculated by conducting tensile and compression tests on human femur cortical bone. The elastic behaviour of bone tissue subjected to tensile load is demonstrated. The strength and flexibility of the human skeletal system depend on a basic frame work of collagen fibres. In the process of aging, changes occur in the collagenous frame work. The major changes are an increase in rigidity of the tissue, the fibres ultimately becoming brittle. Such changes are clearly deleterious to the optimal functioning skeletal system. The changes in collagen cross-linking are major cause for observed change in mechanical properties also the elastic properties with respect to age.
MATERIAL AND METHOD
Human femur cortical bones are chosen as a source material. Femur bones are thicker and longer than any of the human long bones. Consequently specimen preparation is easier and greater ranges of the load capabilities of the testing machines could be utilized. Bones are obtained from cadavers of both genders who were non hospitalised and are not immobilised before the death. A total of 55 femoral samples are obtained and divided into various age groups ranging from 19 years to 83 years. After removal of the soft tissue, femoral bones are wrapped in gauge soaked in a calcium buffered saline solution. Samples are tested with coded labelling to keep the patient information confidential.
Mechanical tests are performed on an Instron 3366 universal testing machine. During all cutting and machining operations, the bone material was frequently and liberally sprayed with saline solution to keep it cool and wet. The finished specimen blocks are cut to 5mmX5mmX15mm dimensions for tensile experimentation and 5mmX5mmX5mm cube for compression experiments. Experiments are conducted according to ADA standards.
RESULTS
The tensile and compression load tests are performed on human femur bone and are analysed to evaluate the resistance to fracture in terms of the stress intensity as a function of age , which is performed for samples of both male and female. Statistical analysis of tensile and compressive strength is summarised in Table 1. The mean tensile strength in males is found to be 39.74 ±4.80 MPa, in females it is found to be 30.08 ±7.96 MPa. The mean compressive strength in males is found to be 141.6 ± 15.91 MPa, in females it is observed to be 118.91±18.99 MPa. The ultimate tensile stress showed no significant difference between the young age, a considerable change is noticed in middle age groups, and significant changes was observed with the old age groups. Young’s modulus is calculated by obtaining the ratio of tensile stress to tensile strain. Young’s modulus showed an initial slow increase in young and middle age groups from 20 – 35 years in both male and female, but is significantly larger in the old age group for both the genders with a maximum at 70 – 80 years. The mean Young’s modulus was found to be 338.3±179
.74 MPa in males, where as 404.7±314.0 MPa in females. Figure 1 shows the tensile and compressive load behaviour with respect to age for males. It is observed that both tensile and compression strengths reduces as age advances, compression strength is more than tensile strength. Curve fit is obtained of third degree polynomial for both graphs and trend line is obtained with R2 value for tensile trend line being 0.94 and that for compression R2 value is 0.78, hence in the given range of age from 19 – 83 years one can find out corresponding tensile and compressive strengths. Variation in Young’s modulus with age for human femur cortical bone of male is demonstrated in Figure 2, curve fit is obtained of third degree polynomial for the plot and the trend line is obtained with R2 value 0.86. It is observed that it is almost constant till the age of 55 years, a small increase is found in the age 55 – 75 years and a significant increase after the age of 75 years and above. This clearly indicates that in males bone is elastic till the age of 55 years which is due to the compactness in the bone tissue organisation and in older ages pores induces into the bone tissue, and decrease in the density it turns it to be brittle.
Table 1. Statistical analysis (Mean, standard deviation, t test and P value) for human cortical femur bone
|
Male |
Female |
T test |
P value |
Tensile strength MPa |
39.74±4.80 |
30.08±7.96 |
5.618 |
<0.001 |
Compressive strength MPa |
141.6±15.91 |
118.91±18.99 |
4.702 |
<0.001 |
Young’s Modulus MPa |
338.3±179.74 |
404.7±314 |
1 |
0.322 |
Tensile and compressive load behaviour for female bones with respect to age is summarized in Figure 3, curve fit is obtained of third degree polynomial for both plots, for tensile strength the trend line is obtained with R2 value 0.98 and the trend line for compressive strength is obtained with R2 value 0.97. In the early stage both tensile and compressive strength remain constant till 25 years, significantly decrease with age till 75 years and remains constant thereafter. The reduction in strength is mainly due to physiological changes after post menopause. Variation in Young’s modulus with age for human femur cortical bone of female is demonstrated in Figure 4, till the age of 55 years there is no considerable variation. It is observed that a significant increase after the age of 55 years and above. Curve fit is obtained of third degree polynomial for the plot and the trend line is obtained with R2 value 0.97. This clearly indicates that bone is turning towards brittle after 55 years of age in females.
Table 2. Statistical analysis of male and female together (Mean, std dev) mechanical properties for human cortical femur bone for different age groups
Age groups no. of samples |
≤ 30 (13) |
31 – 50 (13) |
51 – 70 (15) |
≥ 70 (14) |
F test |
P value |
Tensile strength MPa |
43.44±3.62 |
39.82±4.29 |
33.16±6.43 |
30.16±7.09 |
15.818 |
<0.001 |
Compressive strength MPa |
155.87±9.53 |
142.37±12.12 |
124.44±15.40 |
115.29±12.94 |
27.295 |
<0.001 |
Young’s Modulus MPa |
219.98±23.23 |
246.6±16.44 |
305.1±58.01 |
659.26±301.60 |
23.606 |
<0.001 |
Table 2 summarises statistical analysis of test samples. Both the genders are divided into four age groups. In age group less than 30 years where 13 samples were tested, the mean tensile strength is found to be 43.44±3.62 MPa, the mean compressive strength is found to be 155.87±9.53 MPa and the mean Young’s modulus is 219.98±23.23 MPa. In the age group of 31 – 50 years where 13 samples were examined in this age group the mean tensile strength is found to be 39.82±4.29 MPa, the mean compressive strength is found to be 142.37±12.12 MPa and the mean Young’s modulus is 246.6±16.44 MPa. In the age group of 51 – 70 years where 15 samples were examined, in this age group the mean tensile strength is found to be 33.16±6.42 MPa, the mean compressive strength is found to be 124.44±15.40 MPa and the mean Young’s modulus is 305.1±58.01 MPa. In the old age group of more than 70 years about 14 samples were tested where the mean tensile strength is found to be 30.16±7.09 MPa, the mean compressive strength is found to be 115.29±12.94 MPa and the mean Young’s modulus is 659.26±301.60 MPa. in this particular age group.
Table 3. Statistical analysis of male only (Mean, std dev) mechanical properties for human cortical femur bone of different age groups
Age groups no. of samples |
≤ 30 (9) |
31 – 50 (8) |
51 – 70 (9) |
≥ 70 (10) |
Tensile strength MPa |
43.31±2.21 |
42.24±2.38 |
37.92±2.49 |
34.36±1.83 |
Compressive strength MPa |
161.44±4.56 |
149.34±9.07 |
135.73±3.65 |
122.86±4.34 |
Young’s Modulus MPa |
230.18±16.52 |
254.31±10.20 |
300.32±38.13 |
537.19±246.31 |
Table 3 summarises statistical analysis of mechanical properties of human cortical femur bone for males only. In the age group less than 30 years, about 9 samples are tested and the mean tensile strength is found to be 43.31±2.21 MPa, compressive strength of 161.44±4.56 MPa where these values were highest among others. The Young’s modulus is 230.18±16.52 MPa where this is the least compared to other age groups. This shows that bones are more stronger in this age group also and more ductile comparatively. In the age group of 31 – 50 years about 8 samples are examined, the mean tensile strength is found to be 42.24±2.38 MPa, the mean compressive strength is 149.34±9.07 MPa and mean Young’s modulus was obtained as 254.31±10.20 MPa. in the age group of 51 – 70 years about 9 samples were examined, the mean tensile strength was found to be 37.92±2.49 MPa, the mean compressive strength is about 135.73±3.65 MPa and the mean Young’s modulus is 300.32±38.13 MPa. Significant reduction in tensile and compressive strength is observed these two age groups. In the age group of above 70 years, there were 10 samples examined where the mean tensile strength is found to be 34.36±1.83 MPa, the mean compressive strength is 122.86±4.34 MPa where it is observed that least strength were obtained in this age groups also the mean of Young’s modulus is 537.19±246.31 MPa which indicates as age advances strain induced in tissue level is less hence bone becomes brittle.
Table 4. Statistical analysis of female only (Mean, std dev) mechanical properties for human cortical femur bone of different age groups.
Age groups no. of samples |
≤ 30 (4) |
31 – 50 (5) |
51 – 70 (6) |
≥ 70 (4) |
Tensile strength MPa |
39.23±2.28 |
35.95±3.86 |
26.03±1.95 |
19.65±1.48 |
Compressive strength MPa |
143.35±2.34 |
131.21±6.63 |
107.41±8.07 |
96.35±0.84 |
Young’s Modulus MPa |
197.01±20.37 |
234.36±17.88 |
312.25±83.62 |
964.43±195.78 |
Table 4 summarises statistical analysis of female cortical femur bone of various age groups. In the age group of less than or equal to 30 years, about 4 samples are examined the mean tensile strength is found to be 39.23±2.28 MPa, the mean compressive strength is about 143.35±2.34 MPa. The mean Young’s modulus in this age group is 197.01±20.37 MPa. In the age group of 31 – 50 years about 5 samples are examined where mean tensile strength is obtained as 35.95±3.86 MPa, the mean compressive strength is about 131.21±6.63 MPa and the mean Young’s modulus is 234.36±17.88 MPa. In the age group of 51 – 70 years there are 6 samples for examination, where the mean tensile strength is 26.03±1.95 MPa, the mean compressive strength is about 107.41±8.07 MPa, its Young’s modulus is 312.25±83.62 MPa. In the age group of above 70 years, there are 4 samples examined, where the mean tensile strength is found to be 19.65±1.48 MPa. The mean compressive strength is 96.35±0.84 MPa where it is observed that least strength is obtained in this age groups also the mean of Young’s modulus is 964.43±195.78 MPa. It is clearly noticed that as age advances tensile and compressive strengths reduces where as Young’s modulus increases drastically which indicates bone fragility in older age.
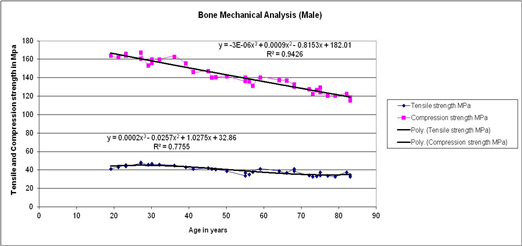
Fig. 1. Variation in Tensile and Compressive strengths with age for the human femur cortical bone of male. A polynomial regression of the data is shown with curve fit equation.

Fig. 2. Variation in Young’s modulus with age for human femur cortical bone of male
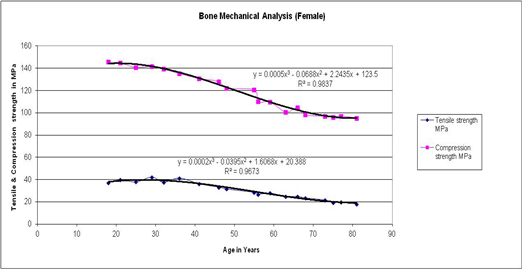
Fig. 3. Variation in Tensile and compressive strengths with age for the human femur cortical bone of female.
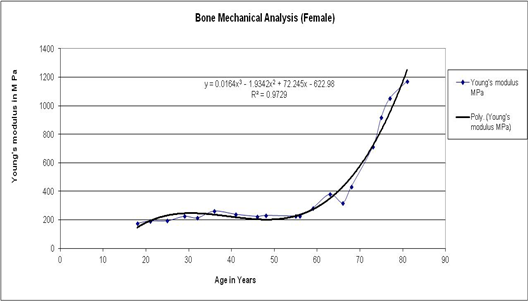
Fig. 4. Variation in Young’s modulus with age for human femur cortical bone of female.
Discussion:
Several structural features of collagen bestow particular tissues with mechanical properties appropriate to their widely varying functions. The total collagen content of the tissue is obviously an important determinant of mechanical strength. The ability of the tissue to sustain an applied load is also determined by the orientation of the fibres which can vary markedly between tissues. The collagen fibrils possess little strength in compression but exhibit a very high tensile strength. The tensile and compressive strength decreases with age. Little change occurs in the Young’s modulus during maturation but considerable in old age. There is an increase in failure stress accompanied by a decrease in failure strain indicating increased cohesion between the micro fibrils, thus preventing slippage[7]. The diameter of the collagen fibres also plays a significant role in determining the mechanical properties of the tissue. The ability to withstand high stress levels is related to the proportion of large diameter fibrils. As the diameter increases the flexibility of the tissue decreases and there is a decrease in the ability to resist crack propagation. In some tissues there is a bimodal distribution of fibre diameter, the voids between the large fibres being filled by small fibres, thus allowing a high collagen content but maintaining a flexibility of the tissue. With maturation, fibril diameters increase and may be either unimodular or bimodally distributed, thus as age advances elastic properties and mechanical strength reduces[8].
The age induced decrease in the fracture toughness of bone is quantified in terms of resistance to both crack initiation and crack growth. As the microstructural factors affecting crack initiation and growth in most materials are invariably quite distinct, the challenge is to identify and quantify the specific mechanisms affecting each process in terms of the changes that occur in the micro or ultra structure of bone with age [9].
The degree of bone mass attained is governed by hormonal, nutritional and mechanical factors. At all ages women have a lower bone mass then men and with the increasing age, this gap widens. For cortical bone, a slow loss of bone mass begins at about age of 40 years in females and at 50 years in males. Additionally women generally experience an accelerated period of bone loss around the menopause. This accelerated loss is associated with the withdrawal of estrogen. The role of estrogen deficiency appears to involve an increase in bone resorption as well as a diminution of bone formation. Thus in males and females, estrogen has both a catabolic and an anabolic effect on bone throughout life. In older men, osteoporosis is more closely related to low estrogen than to low androgen levels [10, 11].
An alternative to strategies aimed at directly promoting bone growth is to indirectly enhance bone mass by increasing the mechanical load on bone. Recent work has identified a molecule named myostatin as a potent inhibitor of skeletal muscle growth. Myostatin is normally made by skeletal muscle cells, circulates in the blood and acts to maintain muscle satellite cells in a quiescent state. When the activity of myostatin is blocked, these satellite cells are activated, proliferate and fuse to existing myofibers causing the fibres to hypertrophy. Although the mechanisms by which myostatin activity is regulated in vivo are still being elucidated, activity can be blocked artificially by a variety of both naturally occurring and engineered myostatin-binding proteins. One engineered binding protein is a neutralizing monoclonal antibody is currently being tested in clinical trials in patients with muscular dystrophy [12, 13, 14]. A successful outcome of these trials in terms of promoting muscle growth would open the possibility of exploiting such agents for other clinical applications, including increasing bone mass.
Conclusion:
The tensile and compressive load tests are performed on human femur bone collected from cadavers. Young’s modulus is calculated for various age groups in the range of 19 – 83 years. Analysis is carried out to evaluate the resistance to fracture in both the genders. The fracture toughness of cortical bone, shows significant deterioration with aging. Results demonstrate the deterioration in bone quality in terms of specific age-related changes. As age advances strength and stiffness of bone reduces due to increased cavity areas and reduced collagen fibres, hence it is observed that bone appears to be elastic till the age of 55 years in males and till 45 in females. Later bone turns out to be brittle due to the increased damage that occurs with age in tissue level. Such an investigation helps from the basis of a micro-mechanistic frame work for understanding mineralized tissue fracture and failure in the context of aging and developing therapies to counter the deleterious effects of the aging process. Understanding of the mechanisms that control bone cell function leads to many advances in musculoskeletal research. The ability to manipulate formation and resorption of bone as needed will substantially improve the treatment of musculoskeletal disorders. Interventions that exploit this knowledge of bone cell function offer the potential to treat numerous bone diseases.
Reference:
[1] Vashishth D., and Sit S., "Age-related changes in bending fatigue of human cortical bone”. 2003 summer Bioengineering Conference, Florida, 2003.
[2] Kotha S. P., and Guzelsu N. "Modeling the tensile mechanical behaviour of bone along the longitudinal direction" J. Theor. Biol, vol. 219, pp. 269-279, 2002.
[3] Tomar V., "Insights into the effects of tensile and compressive loadings on microstucture dependent fracture of trabecular bone," J. of Engineering Fracture Mechanics, 2009.
[4] Bailey A. J., Paul R., and Knott L., "Mechanisms of maturation and ageing of collagen," Mechanisms of ageing and development, vol. 106, pp. 1-56, 1998.
[5] Nalla R. K., Kruzic J. J., Kinney J. H., and Ritchie R. O., "Effect of aging on the toughness of human cortical bone: evaluation by R-curves," J. of Bone, vol. 35, pp. 1240-1246, 2004.
[6] Nalla R. K., Kruzic J. J., Kinney J. H., Balooch M., III J. W. A., and Ritchie R. O., "Role of microstructure in the aging-related deterioration of the toughness of human cotical bone," J. of Material Science and Engineering, vol. 26, pp. 1251-1260, 2006.
[7] Akkus O., Adar F., and Schaffler M. B., "Age-related changes in physicochemical properties of mineral crystals are related to impaired mechanical function of cortical bone," J. of Bone, vol. 34, pp. 443-453, 2004.
[8] Gupta H. S. and Zioupos P., "Fracture of bone tissue : The 'hows' and the 'whys'," J. of Medical Engineering and Physics, vol. 30, pp. 1209-1226, 2008. 4.
[11] George W. T. and Vashishth D., "Susceptibility of aging human bone to mixed-mode fracture increases bone fragility," Bone, vol. 38, pp. 105-111, 2006.
[12] Kotha S. P. and Guzelsu N., "Tensile damage and its effects on cortical bone," J. of Biomechanics, vol. 36, pp. 1683-1689, 2003.
[13] Turner C. H., "Biomechanics of Bone: Determinants of Skeletal Fragility and Bone Quality," Int J. of Osteoporosis, vol. 13, pp. 97-104, 2002.
[14] Roeder B. A., Kokini K., Sturgis J. E., and Robinson J. P., "Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure," in Transactions of ASME, 2002.
|






